mod. 656/95"
Regolamento (CEE) n. 656/95
della Commissione del 28 marzo 1995 che modifica il regolamento (CEE) n. 2568/91, relativo alle caratteristiche degli oli d'oliva e degli oli di sansa d'oliva nonch� ai metodi ad essi attinenti e il regolamento (CEE) n. 2658/87 del Consiglio relativo alla nomenclatura tariffaria e statistica ed alla tariffa doganale comuneLA COMMISSIONE DELLE COMUNIT� EUROPEE,
visto il trattato che istituisce la Comunit� europea,
visto il regolamento n. 136/66/CEE del Consiglio, del 22 settembre 1966, relativo all'attuazione di un'organizzazione comune dei mercati nel settore dei grassi (1), modificato da ultimo dal regolamento (CE) n. 3179/93 (2), in particolare l'articolo 35 bis,
visto il regolamento (CEE) n. 2658/87 del Consiglio, del 23 luglio 1987, relativo alla nomenclatura tariffaria e statistica ed alla tariffa doganale comune (3), modificato da ultimo dal regolamento (CE) n. 3330/94 della Commissione (4), in particolare l'articolo 9,
considerando che il regolamento (CEE) n. 2568/91 della Commissione (5), modificato da ultimo dal regolamento (CE) n. 2632/94 (6), ha definito le caratteristiche degli oli d'oliva e degli oli di sansa d'oliva, nonch� i relativi metodi di analisi; che il regolamento (CEE) n. 2568/91 ha inoltre modificato le note complementari 2, 3 e 4 del capitolo 15 della nomenclatura combinata figurante nell'allegato I del regolamento (CEE) n. 2568/87;
considerando che, tenendo conto degli sviluppi compiuti dalla ricerca, si ravvisa l'opportunit� di adattare le caratteristiche degli oli d'oliva definite dal regolamento (CEE) n. 2568/91, in modo da offrire maggiori garanzie di purezza dei prodotti commercializzati, nonch� di indicare il relativo metodo di analisi;
considerando che alla luce dell'esperienza acquisita appaiono necessari alcuni adattamenti del metodo di determinazione della trinoleina; che d'altro canto, per proseguire l'armonizzazione con le norme internazionali del Consiglio oleicolo internazionale, � opportuno adattare alcuni valori massimi relativi alle caratteristiche degli oli d'oliva e degli oli di sansa d'oliva;
considerando che le modifiche delle caratteristiche degli oli d'oliva considerati richiedono una modifica delle note complementari 2, 3 e 4 del capitolo 15 della nomenclatura combinata;
considerando che, per consentire l'adattamento alle nuove norme e l'adozione dei mezzi necessari per la loro applicazione e per prevenire inoltre perturbazioni negli scambi commerciali, � opportuno differire di due mesi circa l'entrata in vigore del presente regolamento e permettere, per un periodo limitato, lo smaltimento dell'olio condizionato prima della sua entrata in vigore;
considerando che � quindi necessario modificare il regolamento (CEE) n. 2658/87 ed il regolamento (CEE) n. 2568/91, il cui allegato XIV ha modificato dette note complementari;
considerando che le misure previste dal presente regolamento sono conformi al parere del comitato di gestione per i grassi,
HA ADOTTATO IL PRESENTE REGOLAMENTO:
1) all'articolo 2 � aggiunto il seguente trattino:
" - per la determinazione degli stigmastadieni, il metodo figurante nell'allegato XVII. ";
2) gli allegati sono modificati conformemente all'allegato del presente regolamento.
Esso non si applica agli oli d'oliva e di sansa d'oliva condizionati prima della sua entrata in vigore e commercializzati fino al termine del secondo mese ad essa successivo.
Il presente regolamento � obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 28 marzo 1995. Per la Commissione
Franz FISCHLER
Membro della Commissione -----------------------------
(1) GU 172 del 30. 9. 1966, pag. 3025/66.
(2) GU L 285 del 20. 11. 1993, pag. 9.
(3) GU L 256 del 7. 9. 1987, pag. 1.
(4) GU L 350 del 31. 12. 1994, pag. 51.
(5) GU L 248 del 5. 9. 1991, pag. 1.
(6) GU L 280 del 29. 10. 1994, pag. 43.
" Allegato XVII: Metodo di determinazione degli stigmastadieni negli oli vegetali ".
2. Il testo dell'allegato I � sostituito dal seguente:
CARATTERISTICHE DEGLI OLI D'OLIVA
...continua
M = massimo, m = minimo.
(1) Limite massimo complessivo per i composti rivelati dal rivelatore a cattura di
elettroni
Per i componenti accertati singolarmente il limite massimo � 0,10 mg/kg.
(2) Somma di isomeri che (non) potrebbero essere separata mediante colonna capillare.
(3) (Delta-5-23-Stigmastadienolo + Clerosterolo + Sitosterolo + Sitostanolo +
Delta-5-Avenosterolo + Delta-5-24 Stigmastodienolo).
Nota:
Un olio deve essere rifiutato se qualcuna delle caratteristiche non rientra nei limiti
fissati.
...continua
M = Massimo, m = minimo
Nota:
Un olio deve essere rifiutato se qualcuna delle caratteristiche che rientra nei limiti
fissati.
Ai fini della constatazione della purezza, qualora il K270 superi il limite della
categoria corrispondente, si deve procedere alla determinazione del K270 dopo il passaggio
su allumina."
3. Nell'allegato VIII, il testo della nota 5 � sostituito dal seguente:
" Nota 5:
Per gli oli vergini lampanti e per gli oli di sansa d'oliva greggi, al fine di ottenere
una buona separazione del picco della trilinoleina da quelli adiacenti o di eventuali
sostanze interferenti, � necessario purificare preventivamente gli oli conformemente alla
metodologia seguente:
si fanno assorbire 200 ml di olio, senza diluirli, su una colonnina di silice per
estrazione liquido-solido (tipo SEP PAK silica cartridge-waters part. n. 51900).
I trigliceridi vengono eluiti con 20 ml di esano anidro per HPLC in un tempo massimo di 20
sec.
Il prodotto eluito viene essiccato in corrente d'azoto e ripreso in isopropanolo o acetone
(5 ml). Si iniettano 10-20 ml in HPLC. � necessario controllare che la composizione di
acidi grassi dell'olio sia la stessa prima e dopo la purificazione nei limiti di errore
del metodo analitico adottato. ".
4. � aggiunto il seguente allegato XVII:
METODO DI DETERMINAZIONE DEGLI STIGMASTADIENI NEGLI OLI VEGETALI
1. SCOPO
Determinazione degli stigmastadieni negli oli vegetali contenenti basse concentrazioni di
questi idrocarburi, soprattutto oli d'oliva vergini e oli di sansa d'oliva grezzi.
2. OGGETTO
Il metodo pu� essere applicato a tutti gli oli vegetali, ma � attendibile soltanto se il
tenore di questi idrocarburi � compreso tra 0,01 e 4,0 mg/kg. Esso � particolarmente
adatto a rivelare la presenza di oli vegetali raffinati (oliva, sansa, girasole, palma,
ecc.) nell'olio di oliva vergine, dato che gli oli raffinati contengono stigmastadieni,
mentre gli oli vergini non li contengono.
3. PRINCIPIO
Isolamento dell'insaponificabile. Separazione della frazione costituita dagli steroidi a
carattere di idrocarburi mediante cromatografia su colonna di gel di silice e analisi
mediante gascromatografia su capillare.
4. APPARECCHIATURA
4.1. Palloni idonei da 250 ml, con condensatore a riflusso.
4.2. Imbuti separatori da 500 ml.
4.3. Palloni a fondo rotondo da 100 ml.
4.4. Evaporatore rotante.
4.5. Colonna per cromatografia in vetro (1,5-2,0 cm di diametro interno, della lunghezza
di 50 cm) provvista di rubinetto in teflon e di tappo in fibra di lana di vetro o disco di
vetro sinterizzato all'estremit� inferiore. Per preparare la colonna di gel di silice
versare l'esano nella colonna cromatografica fino a raggiungere uno spessore di circa 5 cm
e riempire quindi con un impasto di gel di silice in esano (15 g in 40 ml) aiutandosi con
porzioni di esano. Lasciar depositare completando poi il deposito con leggere vibrazioni.
Aggiungere solfato di sodio anidro fino all'ottenimento di uno spessore di circa 0,5 cm ed
infine eluire l'esano in eccesso.
4.6. Gascromatografo provvisto di rilevatore a ionizzazione di fiamma, iniettore a
separazione o a freddo, lungo la colonna e stufa programmabile con l'approssimazione di �
1 �C.
4.7. Colonna capillare di silice fusa per gascromatografia (0,25 o 0,30 mm di diametro
interno, della lunghezza di 25 m) ricoperte di fase di fenilmetilsilicone al 5 %, spessore
0,25 mm.
Nota 1.
Possono essere usate altre colonne di polarit� equivalente o inferiore.
4.8. Registratore-integratore con possibilit� d'integrazione da valle a valle.
4.9. Microsiringa per gascromatografia da 5-10 ml con ago cementato.
4.10. Camicia di riscaldamento o piastra termica, elettrica.
5. REAGENTI
Tutti i reagenti debbono essere puri per analisi se non specificato diversamente. L'acqua
usata dev'essere distillata oppure di purezza per lo meno equivalente.
5.1. Esano o miscela di alcani con intervallo di ebollizione a 65-70 �C, distillato su
colonna di rettificazione.
Nota 2.
Il solvente dev'essere distillato in modo da eliminare le impurezze.
5.2. Etanolo al 96 % v/v.
5.3. Solfato di sodio anidro.
5.4. Soluzione alcolica di idrossido di potassio al 10 %. Aggiungere 10 ml d'acqua a 50 g
di idrossido di potassio, agitare e sciogliere quindi la miscela in etanolo fino a 500 ml.
Nota 3.
La potassa alcolica vira al bruno se lasciata riposare. Dev'essere preparata di fresco
ogni giorno e tenuta in bottiglie di vetro scure ben tappate.
5.5. Gel di silice 60 per cromatografia su colonna 70-230 mesh (Merck, ref. 7734 o
simili).
Nota 4.
Di regola il gel di silice pu� essere usato prelevandolo direttamente dal contenitore
senza alcun trattamento preliminare. Tuttavia alcune partite di silice sono scarsamente
attive e determinano separazioni cromatografiche di cattiva qualit�. In casi del genere,
il gel di silice dev'essere disattivato scaldandolo per almeno quattro ore a 550 �C;
successivamente, sistemarlo in un essiccatore fino a raffreddamento e trasferirlo quindi
in un pallone provvisto di tappo. Aggiungere il 2 % di acqua e agitare fino a scomparsa
dei grumi e libero flusso della polvere. Il gel di silice dev'essere trattato come sopra
se le partite di gel di silice danno cromatogrammi con picchi di interferenza. Come
alternativa, pu� essere usato gel di silice 60 extra puro (Merck, ref. 7754).
5.6. Soluzione madre (200 ppm) di colesta-3,5-diene (Sigma, purezza 99 %) in esano (10 mg
in 50 ml).
5.7. Soluzione standard di colesta-3,5-diene in esano alla concentrazione di 20 ppm,
ottenuta diluendo la soluzione di cui sopra.
Nota 5.
Le soluzioni 5.6 e 5.7 non si deteriorano per almeno 4 mesi se conservate a una
temperatura inferiore ai 4 �C.
5.8. Soluzione di n-nonacosano in esano ad una concentrazione di circa 100 ppm.
5.9. Gas vettore per cromatografia: idrogeno o elio puro al 99,9990 %.
5.10. Gas ausiliari per il rivelatore a ionizzazione di fiamma: idrogeno puro al 99,9990 %
ed aria purificata.
6. PROCEDIMENTO
6.1. Preparazione dell'insaponificabile:
6.1.1. Pesare 20 g, con l'approssimazione di � 0,1 di olio in un pallone da 250 ml (4.1),
aggiungere 1 ml della soluzione standard di colesta-3,5-diene (20mg) e 75 ml di potassa
alcolica al 10 %, preparare il condensatore a riflusso e portare a leggera ebollizione per
30 minuti. Allontanare il pallone contenente il campione dalla fonte di calore e lasciare
raffreddare leggermente la soluzione (non far raffreddare completamente, altrimenti il
campione si depositerebbe). Aggiungere 100 ml d'acqua e trasferire la soluzione in un
imbuto a decantazione (4.2) con l'ausilio di 100 ml di esano. Agitare la miscela
vigorosamente per 30 secondi e lasciar stratificare.
Nota 6.
Se si forma un'emulsione che non scompare rapidamente, aggiungere piccoli quantitativi di
etanolo.
6.1.2. Trasferire la fase acquosa inferiore in un secondo imbuto separatore ed estrarre
nuovamente con 100 ml di esano. Eliminare ancora la fase inferiore e lavare gli estratti
di esano (raccolti in un altro imbuto separatore) tre volte con tre porzioni, di 100 ml
ciascuna, di una miscela etanolo-acqua (1: 1) fino a raggiungimento di pH neutro.
6.1.3. Far passare la soluzione di esano attraverso del solfato di sodio anidro (50 g),
lavare con 20 ml di esano a far evaporare in evaporatore rotante a 30 �C e bassa
pressione fino a secchezza.
6.2. Separazione della frazione di idrocarburo steroidico:
6.2.1. Trasferire il residuo nella colonna di frazionamento con l'ausilio di due porzioni
di esano da 1 ml, far passare il campione attraverso la colonna lasciando che la soluzione
scenda fino alla sommit� del solfato di sodio e avviare l'eluizione cromatografica con
esano ad una velocit� di efflusso di 1 ml/min. circa. Eliminare i primi 25-30 ml
dell'eluizione e raccogliere quindi la rimanente frazione di 40 ml. Dopo averla raccolta,
trasferirla in un pallone a fondo rotondo da 100 ml (4.3).
Nota 7.
La prima frazione contiene idrocarburi saturi (figura 1a), la seconda quelli steroidici.
Continuando l'eluizione si ottiene squalene e composti connessi. Ai fini di una buona
separazione tra idrocarburi saturi e steroidici, � necessario ottimalizzare le frazioni
di volume. A questo scopo il volume della prima frazione dev'essere regolato in modo che,
quando viene analizzata la seconda frazione, i picchi che rappresentano gli idrocarburi
saturi siano bassi (vedasi figura 1c); se essi non compaiono, ma l'intensit� del picco
standard � bassa, il volume dev'essere ridotto. In ogni caso non � necessaria una
separazione completa dei componenti della prima e seconda frazione, dato che durante
l'analisi gascromatografica non vi � sovrapposizione di picchi, se detta analisi viene
eseguita nelle condizioni precisate al paragrafo 6.3.1. In generale non � necessaria
l'ottimalizzazione della seconda frazione in volume, data la buona separazione degli altri
componenti. Tuttavia la presenza di una grosso picco per un tempo di ritenzione inferiore
di circa 1,5 minuti rispetto allo standard � dovuta allo squalene e sta ad indicare una
cattiva separazione.
6.2.2. Evaporare la seconda frazione in un evaporatore a 30 �C e bassa pressione fino a
secchezza e sciogliere immediatamente il residuo in 0,2 ml di esano. Conservare la
soluzione in frigorifero fino all'analisi.
Nota 8.
I residui 6.1.3 e 6.2.2 non devono essere lasciati asciugare, n� tenuti a temperatura
ambiente. Non appena essi vengono ottenuti, � necessario aggiungere il solvente e
conservare le soluzioni in frigorifero.
6.3. Gascromatografia:
6.3.1. Condizioni operative per l'iniezione a separazione:
- Temperatura dell'iniettore: 300 �C.
- Temperatura del rivelatore: 320 �C.
- Registratore-integratore: i parametri di integrazione devono essere fissati in modo che
forniscano una corretta valutazione delle aree. Si raccomanda un'integrazione da valle a
valle.
- Sensibilit�: circa 16 volte l'attenuazione minima.
- Quantitativo di soluzione iniettato: 1ml.
- Temperature di programmazione della stufa: inizialmente 235 �C per 6 min. e
successivamente aumento di 2 �C/min. fino a 285 �C.
- Iniettore provvisto di separatore di flusso a 1: 15.
- Vettore: elio o idrogeno a una pressione di circa 120 kPa.
Queste condizioni possono essere adeguate alle caratteristiche del cromatografo e della
colonna in modo da ottenere cromatogrammi che rispettino i seguenti requisiti: picco dello
standard interno entro 5 min. circa dei tempi definiti al paragrafo 6.3.2; detto picco
dev'essere pari ad almeno l'80 % della scala completa.
Il sistema gascromatografico deve essere verificato iniettando una miscela della soluzione
madre di colestadiene (5.6) con la soluzione di n-nonacosano (5.8). Il picco del
colesta-3,5-diene deve comparire prima di quello dell'n-nonacosano (figura 1c); se ci�
non succede, si hanno due possibilit�: abbassare la temperatura della stufa e/o usare una
colonna meno polare.
6.3.2. Identificazione del picco Il picco dello standard interno compare dopo circa 19
min. e lo stigmasta-3,5-diene, a un tempo di ritenzione relativo di circa 1,29 (cfr.
figura 1b). Lo stigma-3,5-diene � associato a piccoli quantitativi di un isomero e di
solito entrambi danno origine a un unico picco cromatografico. Tuttavia, se la colonna �
troppo polare oppure mostra un forte potere risolvente, l'isomero pu� comparire sotto
forma di piccolo picco prima e accanto a quello dello stigmasta-3,5-diene (Figura 2). Per
essere certi che gli stigmastadieni vengano eluiti in un picco unico, � consigliabile
sostituire la colonna con una meno polare oppure con una di diametro interno superiore.
Nota 9.
Gli stigmastadieni di riferimento possono essere ottenuti dall'analisi di un olio vegetale
raffinato usando un quantitativo inferiore di campione ( 1-2 g). Gli stigmastadieni danno
un picco significativo e facilmente identificabile.
6.3.3. Analisi quantitativa Il tenore di stigmastadieni viene determinato con la formula
seguente:
mg/kg di stigmastadieni = (As * Mc) / (Ac * Mo)
dove:
As = area del picco dello stigmastadiene (se il picco � ripartito in due isomeri, somma
delle aree dei 2 picchi).
Ac = area dello standard interno (colestadiene)
Mc = massa di standard aggiunto, in microgrammi
Mo = massa di olio prelevata, in grammi
Limite di rivelazione: circa 0,01 mg/kg ".
a) Prima frazione (30 ml) di olio vergine, addizionata intenzionalmente con lo standard.
b) Seconda frazione (40 ml) di olio d'oliva contenente 0,10 mg/kg di stigmastadieni.
c) Seconda frazione (40 ml) contenente una piccola proporzione della prima frazione.
Gascromatogramma ottenuto da un campione di olio di oliva raffinato analizzato su colonna DB-5 che mostra l'isomero dello stigmasta-3,5-diene. |
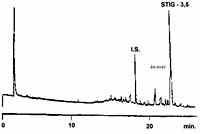 (un click sull'immagine per ingrandirla) |
ALLEGATO II
" 2. A. Rientrano nelle voci 1509 e 1510 soltanto gli oli provenienti esclusivamente dal trattamento delle olive e le cui caratteristiche analitiche relative ai tenori in steroli e in acidi grassi sono quelle di seguito riportate:
Tenore in acidi grassi in % degli acidi grassi totali
| Acido miristico | |
| Acido linoleico | |
| Acido arachico | |
| Acido eicosenoico | |
| Acido beenico (1) | |
| Acido lignocerico |
M = massimo.
(1) M 0,2 per gli oli che rientrano nelle voci 1509
Tenore in steroli in % degli steroli totali
| Colesterolo | |
| Brassicasterolo (1) | |
| Campesterolo | |
| Stigmasterolo (2) | |
| Betasitosterolo (3) | |
| Delta-7-stigmastenolo |
m = minimo.
M = massimo.
(1) M 0,2 fino al 31 ottobre 1995.
(2) Condizione non applicabile per gli oli d'oliva vergini lampanti (codice NC 1509 10 10) per gli oli di sansa d'oliva greggi (codice NC 1510 00 10).
(3) Delta-5,23-stigmastadienolo + clerosterolo + betasitosterolo + sitostanolo + delta-5-avenasterolo + delta-5,24-stigmastadienolo.
Non rientrano nelle voci 1509 e 1510 gli oli d'oliva chimicamente modificati (segnatamente gli oli riesterificati) e le miscele di oli d'oliva e di oli di diversa natura. La presenza di olio d'oliva riesterificato o di oli di diversa natura � determinata mediante i metodi descritti negli allegati V, VII, X A e X B del regolamento (CEE) n. 2568/91.
B. Rientrano nella sottovoce 1509 10 soltanto gli oli d'oliva definiti di seguito ai punti I e II, che sono stati ottenuti esclusivamente mediante processi meccanici o altri processi fisici, in condizioni, segnatamente termiche, tali da non causare alterazioni dell'olio, e che non hanno subito trattamenti diversi dal lavaggio, dalla decantazione, dalla centrifugazione e dalla filtrazione. Gli oli ottenuti dalle olive mediante solventi rientrano nel codice NC 1510.
I. � considerato "olio di oliva vergine lampante" ai sensi della sottovoce 1509 10 10 l'olio che, indipendentemente dalla sua acidit�, presenti:
a) tenore in cere non superiore a 350 mg/kg;
b) tenore in eritrodiolo + uvaolo non superiore a 4,5 %;
c) contenuto di acidi grassi saturi in posizione 2 dei trigliceridi non superiore a 1,3 %;
d) somma degli isomeri transoleici non superiore a 0,10 % e somma degli isomeri translinoleici + translinolenici non superiore a 0,10 %.
e) una o pi� delle seguenti caratteristiche:
1) numero di perossidi pari o superiore a 20 mEq di ossigeno attivo /kg;
2) tenore in solventi alogenati volatili totali pari o superiore a 0,20 mg/kg e pari o superiore a 0,10 mg/kg per almeno uno di essi;
3) coefficiente di estinzione K270 pari o superiore a 0,250 e, dopo trattamento dell'olio su allumina attivata, non superiore a 0,11; in realt�, certi oli aventi tenore in acidi grassi liberi, espresso in acido oleico, superiore a 3,3 g/100 g possono avere, dopo passaggio su allumina attivata conformemente al metodo descritto nell'allegato IX del regolamento (CEE) n. 2568/91, un coefficiente di estinzione K270 superiore a 0,10; in tal caso, dopo neutralizzazione e decolorazione effettuate in laboratorio conformemente al metodo descritto nell'allegato XIII del regolamento citato, essi debbono presentare le caratteristiche seguenti:
- coefficiente di estinzione K270 non superiore a 1,20 - variazione (K) del coefficiente di estinzione in prossimit� di 270 nm superiore a 0,01 e non superiore a 0,16, � cio�:
D K = Km - 0,5 (Km-4 + Km+4)
Km = indica il coefficiente di estinzione alla lunghezza
d'onda del massimo della curva di assorbimento in prossimit� di 270 nm, e
Km-4 e Km+4 = indica i coefficienti di estinzione alla lunghezza d'onda inferiore e
superiore di 4 nm a quella di Km;
4) caratteristiche organolettiche che evidenzino difetti percepibili con un'intensit�
superiore al limite di accettabilit�, con punteggio inferiore a 3,5 nell'analisi
sensoriale di cui all'allegato XII del regolamento (CEE) n. 2568/91.
5) tenore in stigmastadieni non superiore a 0,50 mg/kg.
II. � considerato "altro olio d'oliva vergine" ai sensi della sottovoce 1509 10
90, l'olio di oliva che presenti le seguenti caratteristiche:
a) acidit�, espressa in acido oleico, non superiore a 3,3 g/100 g;
b) numero di perossidi non superiore a 20 mEq di ossigeno attivo/kg;
c) tenore in cere non superiore a 250 mg/kg;
d) tenore in solventi alogenati volatili non superiore a 0,20 mg/kg e, per ciascuno di
essi, non superiore a 0,10 mg/kg;
e) coefficiente di estinzione K270 non superiore a 0,25 e, dopo passaggio dell'olio su
allumina attivata, non superiore a 0,10;
f) variazione (K) del coefficiente di estinzione in prossimit� di 270 nm non superiore a
0,01;
g) caratteristiche organolettiche che evidenzino anche difetti percepibili con
un'intensit� inferiore al limite di accettabilit�, con punteggio pari o superiore a 3,5
nell'analisi sensoriale di cui all'allegato XII del regolamento (CEE) n. 2568/91;
h) tenore in eritrodiolo + uvaolo non superiore a 4,5 %;
i) contenuto in acidi grassi saturi in posizione 2 dei trigliceridi non superiore a 1,3 %;
k) somma degli isomeri transoleici non superiore a 0,05 % e somma degli isomeri
translinoleici + translinolenici non superiore a 0,05 %.
l) tenore in stigmastadieni non superiore a 0,15 mg/kg.
C. Rientra nella sottovoce 1509 90 l'olio d'oliva ottenuto dal trattamento degli oli delle
sottovoci 1509 10 10 e/o 1509 10 90, anche tagliato con olio d'oliva vergine, che presenti
le seguenti caratteristiche:
a) acidit�, espressa in acido oleico, non superiore a 1,5 g/100 g;
b) tenore in cere non superiore a 350 mg/kg;
c) coefficiente di estinzione K270 non superiore a 1,0;
d) variazione del coefficiente di estinzione (D K) in prossimit� di 270 nm non superiore
a 0,13;
e) tenore in eritrodiolo + uvaolo non superiore a 4,5 %;
f) contenuto di acidi grassi saturi in posizione 2 dei trigliceridi non superiore a 1,5 %;
g) somma degli isomeri transoleici non superiore a 0,20 % e somma degli isomeri
translinoleici + translinolenici non superiore a 0,30 %.
D. Sono considerati "oli greggi" ai sensi della sottovoce 1510 00 10 gli oli, e
particolarmente gli oli di sansa d'oliva, che presentano le seguenti caratteristiche:
a) acidit�, espressa in acido oleico, pari o superiore a 2 g/100 g;
b) tenore in eritrodiolo + uvaolo pari o superiore a 12 %;
c) contenuto di acidi grassi saturi in posizione 2 dei trigliceridi non superiore a 1,8 %;
d) somma degli isomeri transoleici non superiore a 0,20 % e somma degli isomeri
translinoleici + translinolenici non superiore a 0,10 %.
E. Rientrano nella sottovoce 1510 00 90 gli oli ottenuti dal trattamento degli oli di cui
alla sottovoce 1510 00 10, anche tagliati con olio d'oliva vergine, nonch� gli oli che
non presentano le caratteristiche degli oli di cui alle note complementari 2. B, 2. C e 2.
D. Gli oli di questo codice devono presentare un contenuto di acidi grassi saturi in
posizione 2 dei trigliceridi non superiore a 2,0 %, una somma degli isomeri transoleici
inferiore a 0,40 % e una somma degli isomeri translinoleici + translinolenici inferiore a
0,35 %.
3. Non rientrano nelle sottovoci 1522 00 31 e 1522 00 39:
a) i residui provenienti dalla lavorazione delle sostanze grasse contenenti olio con
indice di iodio, determinato secondo il metodo indicato all'allegato XVI del regolamento
(CEE) n. 2568/91, inferiore a 70 o superiore a 100;
b) i residui provenienti dalla lavorazione delle sostanze grasse contenenti olio con
indice di iodio compreso tra 70 e 100, ma per il quale la superficie del picco
corrispondente al tempo di ritenzione del betasitosterolo (1), determinata conformemente
dell'allegato V del regolamento (CEE) n. 2568/91, rappresenta meno del 93,0 % della
superficie totale dei picchi degli steroli.
4. I metodi di analisi per la determinazione delle caratteristiche dei prodotti di cui
sopra sono quelli descritti negli allegati del regolamento (CEE) n. 2568/91.
(1) Delta-5,23-stigmastadienolo + clerosterolo + betasisterolo + sitostanolo + delta-5-avenasterolo + delta-5,24-stigmastadienolo.



